Атмосфера планеты обладает внушительным весом — 5,3 миллиарда тонн. Если бы, к примеру, возникла необходимость доставить груз, равный весу атмосферы Земли, из Астаны в Алматы, при условии, что каждый поезд состоит из 100 вагонов и проходит все расстояние за 10 часов, то на осуществление этой транспортировки потребовалось бы почти 4 миллиарда лет. Это пример показывает не только величину нашей атмосферы, но и масштабность задач, связанных с ее изучением и охраной.
Какой воздух продлевает жизнь, и что будет, когда кислород закончится
Воздух—это критически важное вещество, без которого жизнь на Земле невозможна. Атмосфера нашей планеты — уникальная особенность, выделяющая ее среди других небесных тел. Это мощная система, значение которой мы начинаем осознавать только сейчас. Справедливо ли утверждение, что кислород может быть ядом? Существует ли вероятность исчезновения атмосферы? Возможно ли существование жизни без воздуха? Все эти вопросы изучает передовая программа «Как устроен мир» с Тимофеем Баженовым на канале РЕН ТВ.
Химия метаболизма
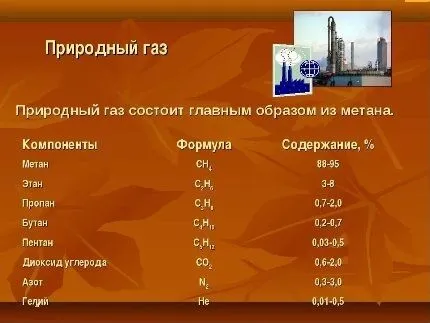
Атмосфера Земли состоит в основном из азота, который составляет 78 процентов, и кислорода, доля которого приблизительно 21 процент. Остальные компоненты, такие как углекислый газ, аргон, неон, гелий и другие газы, присутствуют в гораздо меньших концентрациях. Все эти газы, если рассматривать их изолированно, могут быть токсичны для живых организмов. Однако человеческое тело приспособлено к определенной смеси этих газов, что и позволяет нам жить. Частота и качество дыхания оказываются зависимыми от множества факторов, в том числе от обмена веществ в организме. Например, маленькие птицы, обладающие быстрым метаболизмом, требуют значительного количества кислорода и дышат гораздо чаще, при этом их жизнь обычно коротка. В этом контексте можно провести аналогию с гоночными автомобилями: они имеют крупные воздухозаборники, что позволяет им быстро рассеивавать теплый воздух. В противоположность этому, черепахи, которые вдыхают воздух всего два-три раза в минуту, живут сотни лет. Таким образом, скорость метаболизма играет ключевую роль: чем быстрее он протекает, тем более интенсивной и кратковременной оказывается жизнь. Сам метаболизм заключается в скорости окислительных реакций, где кислород является необходимым компонентом.

«Окисление критически необходимо для того, чтобы энергия могла быть использована для производства белков, из которых состоит человеческий мозг. Именно мозг генерирует электромагнитные сигналы, которые позволяют хранить, дублировать и передавать информацию. Таким образом, люди стали вершиной эволюции не только потому, что они являются хищниками в пищевой цепи, но и потому, что смогли накапливать и развивать новые знания,» — отмечает математик Максим Шингаркин.
Завод в грудной клетке
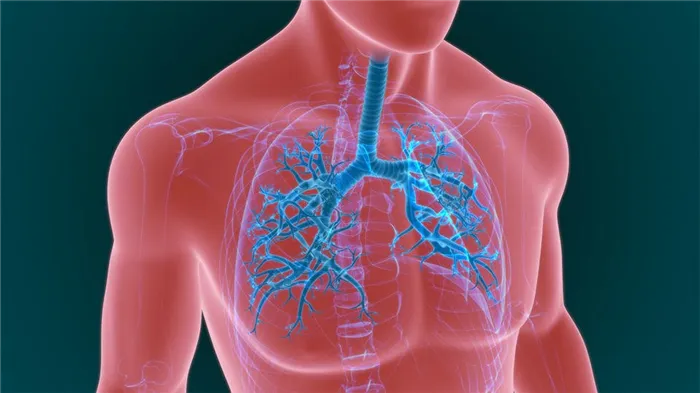
Легкие человека представляют собой удивительно сложный механизм. Задача разделения газов, которые имеют схожую плотность, является крайне сложной даже для современных химиков. Человеческая дыхательная система исполняет функцию, которая под силу лишь крупным растениям. Газы, растворенные в крови, транспортируются ко всем частям организма. Мы остаемся живыми до тех пор, пока в клетках нашего тела продолжаются окислительные реакции. Люди — это аэробные существа, и кислород является ключом к нашему существованию. Красные кровяные тельца, благодаря содержащемуся в них кислороду, окрашивают кровь в красный цвет. Однако у некоторых организмов — например, у тех, которые содержат хлор и фтор, — кровь может иметь голубой цвет. К таким организмам относят некоторых пауков и морских существ.
При третьей степени отравления: содержание угарного газа в атмосфере не превышает 0,08%, карбоксигемоглобина в крови претерпевает изменения, оставаясь в пределах 30%. У пострадавшего могут наблюдаться симптомы головной боли, головокружения, тошноты и рвоты.
АТМОСФЕРА, ЕЕ СОСТАВ, СТРОЕНИЕ И ЗНАЧЕНИЕ. презентация к уроку по географии на тему
Если ваш ребенок потерял знания за летний период и столкнулся с низкими результатами в учебе, нет причин для паники! Опытные репетиторы помогут восстановить забытое и лучше разобраться в учебной программе. Просто посетите наш сайт и запишитесь на бесплатный пробный урок.
Бесплатный вводный онлайн-урок длительностью 30 минут
Предварительный просмотр:
Урок географии об атмосфере, ее строении и значении.
Урок географии предназначен для шестого класса. Он включает в себя изучение новой темы с использованием ИКТ, а также организует учащихся для самостоятельной работы.

Самостоятельная работа в течение 15 минут по теме: АТМОСФЕРА (состав, структура, температура воздуха, атмосферное давление). 6 класс, География
Самостоятельная работа для учащихся 6 класса продолжается 15-20 минут. Тема работы: АТМОСФЕРА (вопросы о составе, структуре, температуре воздуха и атмосферном давлении).

Атмосфера, ее структура и значение» Урок
Названный урок рассматривает структуру атмосферы, ее текстуру и значение.

Атмосфера. Значение, состав, структура и изучение
Презентация «Атмосфера, ее состав, строение и значение» создана для урока по географии в 6 классе на тему «Строение атмосферы».

Урок «Атмосфера — состав, структура и значение», 6 класс.
Этот урок географии также предназначен для шестого класса.

Атмосфера. Ее структура и значение.
Обсуждается структура атмосферы и ее значение для жизни на Земле.

Атмосфера: состав, структура.
Все работы по теме «Атмосфера: состав и структура» направлены на оценку знаний учащихся, поскольку количество уроков в учебной четверти, кроме третьего года обучения, имеет ограничения.
ОТВЕТ ОТВЕТ Что является самым большим газом в воздухе? Какой газ необходим для фотосинтеза? Какой газ нужен для горения, разложения и дыхания? Почему озоновые дыры представляют опасность? Какой слой атмосферы нас окружает? Почему для полетов в стратосфере, помимо топлива, необходимо держать запас кислорода в баллонах? 10
Степень токсичности различных веществ варьируется в зависимости от их химических и физических свойств. Продукты, возникающие в процессе сгорания, могут вызывать разнообразные патологические синдромы, взаимодействуя с человеческим организмом.
В соответствии с международной классификацией болезней десятого пересмотра (МКБ-10), отравление продуктами сгорания обозначается кодом T59, который охватывает «Токсическое действие других газов, паров и испарений».
Что касается механизма воздействия токсичных веществ на человека, токсические компоненты табачного дыма условно делятся на пять основных категорий.

- Вещества, вызывающие повреждение кожи и слизистых оболочек. Симптоматика отравления подобными продуктами сгорания включает зуд, жжение кожи и ее воспаление, дискомфорт в глазах, слезотечение и кашель. Примеры таких веществ — смоляные испарения, диоксид серы и формальдегид.
- Продукты горения, тяжелые для дыхания, приводящие к острым отравлениям. Люди, подвергшиеся воздействию таких токсиков, жалуются на одышку и кашель. При осмотре можно заметить учащенное дыхание и бледность кожи. В случаях высоких концентраций токсичных газов может произойти остановка дыхания. Например, симптомы отравления ПВХ могут проявиться в течение нескольких часов. Ингаляционное отравление связано с хлором, аммиаком и оксидом азота.
- Токсичные вещества, которые связываются с гемоглобином, называемые «ядами крови». Эти соединения нарушают доставку кислорода к клеткам и приводят к системным патологическим реакциям. Примеры включают угарный газ и диоксид азота.
- Продукты сгорания, которые нацелены на нервную систему. К ним относятся бензол и сероводород.
- Яды-ферменты, нарушающие тканевое дыхание, ослабляя активность кислорода. К таким веществам относятся сероводород и синильная кислота.
Многие токсины, образующиеся в процессе сгорания, обладают универсальным действием, так как могут оказывать негативное влияние на множество систем организма одновременно.
Первая помощь при отравлении
Симптомы отравления различаются, однако принципы оказания первой помощи остаются неизменными.
Наиболее распространенный способ попадания токсинов в организм — через дыхательные пути. Если вы стали свидетелем отравления, например, в состоянии алкогольного опьянения, первое, что следует сделать, — это предотвратить попадание продуктов горения в организм пострадавшего. Для этого необходимо предпринять следующие меры:
- если это безопасно и возможно, прекратить поступление токсичного вещества (газа, дыма) внутрь помещений,
- проветрить помещение или территорию, где находится пострадавший,
- снять загрязненную одежду,
- если нет противопоказаний, переместить пострадавшего в безопасное место.

Критические случаи отравления требуют срочного вмешательства. В случае отравления продуктами горения, пожалуйста, примите следующие меры:
- сразу же вызовите скорую помощь,
- если в воздухе присутствует дым, позаботьтесь о защите дыхательных органов от токсинов,
- в случае появления признаков раздражения — промойте глаза, нос и рот,
- если пострадавший не при сознании, держите его в горизонтальном положении и обеспечьте безопасность дыхательных путей,
- следите за состоянием сознания, дыханием, пульсом и кровяным давлением до прибытия медицинского персонала,
- при наличии признаков серьезного состояния незамедлительно начинайте сердечно-легочную реанимацию.
Некоторые отравления могут проявлять период стабильного благополучия. Даже если пострадавший не жалуется на текущее состояние, важно внимательно следить за ним, открывая малейшие признаки заболевания. При появлении первых симптомов немедленно обращайтесь к специалистам.
Важно отметить, что у детей отравление происходит быстрее, чем у взрослых, что связано с более активным потреблением кислорода. Дети могут выражать недомогание через головную боль, усталость, слезотечение и тошноту. Осматривая ребенка, можно заметить бледность кожи, учащенное затрудненное дыхание и ухудшение координации. Принципы первой помощи для детей аналогичны таковым для взрослых, однако отсутствие квалифицированной медицинской помощи может привести к необратимым намекам на центральную нервную систему малыша.
Источник: Пожаро- и взрывобезопасность горючих веществ и материалов и средств пожаротушения: Справочник, Баратов А.Н., Корольченко А.Ю., Москва, 1990.
При горении углерода, водорода и серы кислород поступает из воздуха. Однако само горючее вещество может содержать кислород, который также принимает участие в процессе сгорания. В таких случаях для сгорания веществ требуется меньше воздуха.
Условия возникновения и прекращения горения
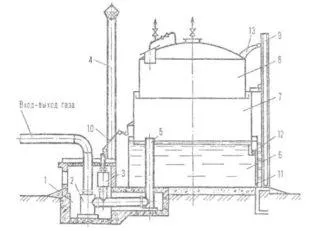
Пожар возникает при наличии трех элементов (рис. 5): первый элемент — топливо, которое может быть представлено сушеной древесиной, бумагой, спиртом или газом. Второй элемент — это кислород, который в итоге взаимодействует с топливом, вызывая его сгорание. Третий элемент — тепло, необходимое для начала реакции. Важно понимать, что топливо в воздухе начинает гореть только при достижении определенной температуры. Поэтому для остановки пожара необходимо либо ограничить доступ кислорода, либо существенно понизить температуру, либо устранить источник зажигания (например, угли).
Для гашения пламени используют углекислый газ или специальные гелевы составы, которые направляются на источник огня, тем самым уменьшая доступ кислорода к горючему материалу. Небольшие возгорания можно эффективно ликвидировать, накрывая их плотным куском ткани, например, брезентом или одеялом, или засыпая песком. Вода же виртуозно подходит для тушения возгораний от угля или древесины, поскольку охлаждает их, одновременно создавая водяное облако, которое препятствует доступу кислорода.
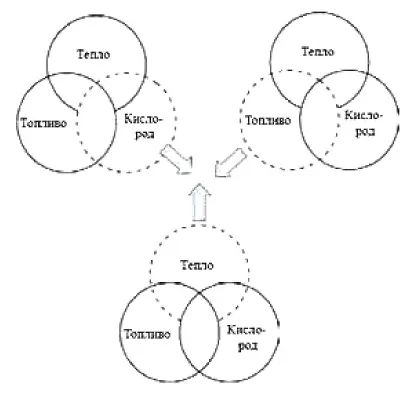
Самое важное, что следует запомнить:
Горение представляет собой химическую реакцию, в ходе которой происходит окисление веществ с выделением тепла и света. Оно происходит медленнее в воздухе по сравнению с кислородом. Соединения, образующиеся при горении, называются оксидами, которые являются сложными веществами, состоящими как минимум из двух элементов, один из которых непременно — кислород.
Образование основных и кислотных оксидов
Изучая горение различных элементов, таких как сера, фосфор и железо, можно заметить, что как металлы, так и неметаллы при сгорании образуют оксиды. Давайте проведем следующие эксперименты для изучения свойств оксидов и их взаимодействий.
Эксперимент 1
Возьмите немного свежего оксида кальция (негашеной извести) и поместите его в фарфоровую чашку, заливая водой. В процессе реакции выделяется большое количество тепла, что свидетельствует о химической активности. В результате этой реакции получается сыпучий порошок, который при растворении в воде образует мыльное соединение. Изменение цвета растворимого вещества на синий подтверждает образование основания. Можно представить себе схему реакции между оксидом кальция и водой:
| Оксид кальция + вода |
Таким образом, оксиды металлов соответствуют основаниям, которые в свою очередь называют щелочами.
Растворимые основания изменяют цвет индикаторов, которые могут использоваться для определения pH растворов.
* Тематика о показателях pH подробно описана в § 11.
Из этого эксперимента можно сделать вывод, что оксиды металлов можно классифицировать как основные оксиды.
Эксперимент 2
Заполните мензурку горячей водой и добавьте несколько капель фиолетового раствора лития, затем сожгите красный фосфор с помощью металлической ложки на поверхности воды. Будет наблюдаться образование оксида фосфора, который проявляется в виде белого дыма и постепенно растворяется в воде, образуя фосфорную кислоту. Изменение цвета раствора лития на красный сигнализирует о том, что кислотные свойства активировались, подтверждая, что неметаллические оксиды соответствуют кислотам. Вы можете представить себя схематически, как выглядит реакция:
| Оксид фосфора (V) + вода |
Самое важное, что нужно усвоить:
При сгорании металлов образуются основные оксиды, которые могут быть классифицированы как основания. Находящиеся в растворе основания называют щелочами. Окисление неметаллов приводит к образованию кислотных оксидов, которые связано с образованием кислот. Есть определенные соединения, которые меняют цвет под воздействием кислот и оснований, называемые индикаторами.
Химические услуги, которые могут вам потребоваться:
Лекции по химии.
Лекции по неорганической химии.
Лекции по органической химии.
Вы можете отправлять свои запросы в любое время суток ➔.
Это официальный сайт Натальи Брилёновой, профессора кафедры информатики и электроники Екатеринбургского государственного института.
Все права на представленный материал принадлежат его владельцам. Коммерческое использование и распространение материалов строго запрещено, кроме как в формате для предварительного ознакомления на сайте natalibrilenova.ru. Публикация и распространение материалов не предназначено для коммерческого использования.
Сайт предназначен для помощи студентам как очной, так и заочной форм обучения. Наталья Брилёнова не предлагает товары или услуги.
В случае использования материалов, обязательно укажите ссылку на сайт natalibrilenova.ru.
При горении углерода, водорода и серы кислород берётся из воздуха. Однако само горючее вещество может содержать кислород, принимающий участие в процессе сгорания. В ситуациях, когда горючее вообще содержит кислород, для его сжигания требуется меньше воздуха.
Первая помощь при отравлении угарным газом

Врачи выделяют три степени отравления угарным газом (CO):
1. При концентрации карбоксигемоглобина в крови на уровне 20-30% пострадавший может испытывать кашель, чихание, возможна потеря сознания, искажение восприятия реальности, а также повышение артериального давления. Дыхание становится тяжелым и поверхностным, пострадавший жалуется на утомляемость и головную боль.
2. При уровне карбоксигемоглобина от 30% до 40% возникают психические расстройства, возможны галлюцинации (как слуховые, так и зрительные), психомоторное возбуждение либо заторможенность. Может наблюдаться потеря сознания, длительные судороги (тонические) и короткие спазмы (клонические). Если в процессе рвоты появляется розовая пена, это может быть признаком отека легких.
3. Если карбоксигемоглобин превышает 50%, у пострадавшего могут начаться серьезные клинические проявления, быстрее всего он может остаться без сознания. Возможны также нарушения в дыхании — цианоз конечностей и аритмия. В заключительной стадии можно констатировать коматозное состояние. Примечание: жизнь человека может оборваться через остановку сердца или дыхательной недостаточности.
Следует подчеркнуть, что отравление угарным газом — это крайне опасная ситуация, требующая немедленной помощи. Первая помощь заключает в себе вызов скорой помощи.
Если вы столкнулись с отравлением угарным газом, вашу первую задачу — вывести пострадавшего на свежий воздух и, по возможности, применить гипервентиляцию легких — заставляйте его дышать глубоко и часто. Если пострадавший не может дышать самостоятельно, вам может понадобиться устроить ему искусственное дыхание. Важно помнить, что при малейшем подозрении на отеки легких не начинать искусственное дыхание.
Для оказания первой помощи при отравлении угарным газом врачи используют следующие группы препаратов:
- Стимуляторы дыхания, которые могут активировать дыхательный центр (например, кофеин) и рефлекторные стимуляторы дыхания (лобелин),
- Антиоксиданты, которые укрепляют организм в условиях гипоксии (ко-карбоксилаза),
- Специфические антидоты против угарного газа (например, ацизол), которые снижают сродство гемоглобина к угарному газу и уменьшают интоксикацию.
Поиск эффективного антидота для быстрого и действенного устранения отравления угарным газом ведется на протяжении многих лет. Недавние исследования показали, что соединение под названием ранолазин, присутствующее в компонентах препаратов от стенокардии, может эффективно защищать сердце от последствий воздействия угарного газа. Исследования о возможных высокоэффективных антидотах продолжаются, однако конкретные решения пока отсутствуют.
Ответив на вопросы теста, вы сможете определить свою предрасположенность к одному из самых распространенных заболеваний, связанных с курением — хронической обструктивной болезни легких (ХОБЛ).
К твердым видам топлива относятся каменный уголь, бурый уголь, торф и дрова; к жидким видам топлива — нефтепродукты, такие как бензин, парафин, мазут и прочие; к газообразным видам топлива принадлежат природные и попутные нефтяные газы, а также другие промышленные газы.
«Когда дыхание затрудняется или приостанавливается, углекислый газ начинает накапливаться, а кровь подкисляется. Это создает условия для вытеснения кислорода из крови к клеткам тканей,» — разъясняет Владимир Сывороткин, кандидат геолого-минералогических наук.
Химия пламени

Первые попытки проникновения в сущность горения и его механизмов принадлежат англичанину Роберту Бойлю, французу Антуану Лорана Лавуазье и русскому ученому Михаилу Васильевичу Ломоносову. В процессе горения, как выяснилось, вещество не просто исчезает, как это могло показаться прежде, а превращается в другие вещества, среди которых преобладают газообразные, и поэтому невидимые. Лавуазье в 1774 году первым доказал, что примерно одна пятая часть воздуха исчезает при горении. В девятнадцатом веке исследования по физическим и химическим процессам, происходящим при горении, стали особенно актуальными в свете происходящих взрывов и пожаров в шахтах.
В конце девятнадцатого века были выявлены основные химические реакции, сопровождающие горение, однако многие аспекты химии пламени остаются неясными и по сей день. Их тщательное изучение происходит в современных лабораториях с использованием новейших методов. Эти исследования обладают несколькими целями: оптимизация процессов сгорания на теплоэлектростанциях и в цилиндрах двигателей внутреннего сгорания для предотвращения взрывного сгорания при сжатии смеси воздуха и бензина в двигателе автомобиля, а также снижение количества загрязняющих веществ, образующихся при горении, и исследование более эффективных методов тушения огня.
Существует два основных типа пламени. Топливо и окислитель (обычно кислород) могут доставляться в зону горения либо принудительно, либо самопроизвольно. Либо данные компоненты могут быть предварительно смешаны, что делает их способными к горению даже в отсутствии воздуха, что, для примера, наблюдается при движении пороха, пиротехнических смесей для фейерверков и ракетного топлива. Также горение может происходить как за счет кислорода, поступающего из воздуха, так и за счет кислорода, содержащегося в окислителе. Примером такого окислителя может служить перхлорат калия (хлорат калия KClO3), который представляет собой высокореактивный переносчик кислорода. Один из самых мощных окислителей — азотная кислота HNO3, которая может зажигать многие органические вещества. Нитраты, соли азотной кислоты — например, в составе удобрений, содержащих аммиачную или калиевую селитру — могут быть крайне опасны, если смешаны с топливами. Другим важным окислителем является закись азота N2O4, применяемая в ракетных топливах. Кислород также может заменять сильные окислители, такие как хлор, который сжигает множество веществ, или фтор, который считается одним из самых сильных окислителей и горит даже в воде.
Перед тем как начнется горение, необходимо выполнить несколько требований. Прежде всего, темперatura горючего вещества должна достигнуть определенного минимума, именуемого температурой воспламенения. Название романа Рэя Брэдбери «451 °F» происходит от температуры, при которой загорается бумага. Эта температура, известная как «температура воспламенения», обозначает предел, после которого твердое топливо выделяет горючие пары или газообразные продукты разложения в достаточном количестве для стабильного горения. Например, сухая сосновая древесина имеет примерно такую же температуру воспламенения.
Самодельные зажигалки времен Великой Отечественной войны (одна сделана из патрона от пневматической винтовки). Изображение: Химия и жизнь
Температура пламени, безусловно, зависит от вида топлива и условий его сгорания. Например, температура пламени метана может достигать 1900 °C в атмосфере и 2700 °C при горении в чистом кислороде. Еще более высокие температуры возникают при горении водорода (2800 °C) и ацетилена (3000 °C). Неудивительно, что пламя ацетиленового резака способно резать практически любой металл. Самый высокий зарегистрированный уровень температуры, около 5000 °C, был зафиксирован в высококипящей жидкости — субнитриде углерода C4N2. По некоторым сведениям, пламя в озоно-кислородной атмосфере может достичь 5700 °C. При сжигании жидкости в воздухе оно проявляет красное, коптящее пламя с зелено-фиолетовым контуром. Существует также явление холодного пламени. Например, пары фосфора могут гореть при низком давлении. Холодное пламя также наблюдается при окислении дисульфида углерода и легких углеводородов при определенных условиях; к примеру, пропан может выдавать холодное пламя при пониженном давлении и температуре от 260 до 320 °C.
Совсем недавно, в последней четверти XX века, стало более понятно, как происходят процессы, связанные с горением различных видов топлива; механизм этих процессов специфицирован, но остается очень сложным. Исходные молекулы часто слишком велики для непосредственного взаимодействия с кислородом, чтобы переработаться в конечные продукты реакции. Взаимодействие октана, к примеру одного из бензиновых компонентов, описывается уравнением: 2C8H18 + 25O2 → 16CO2 + 18H2O. Однако все 8 атомов углерода и 18 атомов водорода из молекулы октана не могут соединиться одновременно с 50 атомами кислорода. Это предполагает, что в реакции горения происходит множество этапов, на каждом из которых лишь некоторые связи разрываются и образуются. Сам процесс представляет собой совокупность элементарных реакций, наблюдение за которыми формирует впечатление огня. Исследовать элементарные реакции стало сложной задачей прежде всего из-за низких концентраций реагентов и промежуточных продуктов в пламени, делая их трудным предметом для изучения.
Внутри пламени
Оптическое лазерное сканирование разных участков пламени дало возможность установить качественный и количественный состав активных частиц, присутствующих в этой среде — фрагментов молекул горючих веществ. Было установлено, что даже в простейшей реакции между водородом и кислородом (2H2 + O2 → 2H2O) разыгрывается более 20 элементарных реакций с участием O2, H2, O3, H2O2, H2O, а также активные частицы H, O, OH и NO2. Например, известный английский химик Кеннет Бейли делился своими альбомами о реакции водорода и кислорода, состоящими из нескольких сотен страниц. Даже высококвалифицированные химики порой изумляются, когда сталкиваются с томами, посвященными реакции кислорода с водородом, созданными Хиншелвудом и Уильямсоном в 1934 году. В 1948 году вышла еще невероятно подробная работа А. Б. Налбандяна и В. В. Налбандяна, посвященная механизму окисления и горения водорода.
Современные методы исследования позволили глубже изучить отдельные фазы процесса и измерить скорости взаимодействия различных активных частиц среди себя, а также со стабильными молекулами при разных температурных режимах. Знание механизмов взаимодействия не только позволяет создать полную картину процесса сгорания, но и требуется для составления модели пламени. Данная задача является сложной из-за необходимости учитывать не только весь комплекс элементарных реакций, но и математически описывать процессы диффузии частиц, теплопередачи и конвективных токов, организующих характерные для огня танцы языков.