Регулярно наблюдается поток (FLUX), который заполняет ядро провода. Его содержание варьируется от 1 до 3,5% и указывается в процентах. Данный форм-фактор исключает необходимость отдельной подачи потока во время эксплуатации, что значительно упрощает процесс.
Плавка олова, его добыча и применение
Олово — это химический элемент, который обозначен в периодической таблице Менделеева как элемент группы легких металлов с атомным номером 50. Это материал, обладающий ковкостью и пластичностью, а также естественным металлическим блеском, что делает его привлекательным для многих промышленных и бытовых применений.
Исторически олово известно человечеству с IV тысячелетия до нашей эры, о чем свидетельствуют археологические находки. Его упоминания можно найти в библейских текстах, в частности, в четвертой книге Моисея. Это говорит о том, что олово играло важную роль в развитии цивилизации с древних времен.
На начальном этапе олово было не столь доступным, как, например, медь. Оно использовалось в основном правителями, военачальниками, богатыми торговцами и купцами, что подчеркивает его высокую ценность. Олово стало важным компонентом медно-оловянного сплава — бронзы, появившейся в середине III тысячелетия до нашей эры, которая на тот момент была одним из самых прочных сплавов. Металлические компоненты бронзового века играли ключевую роль в строительстве и производстве оружия.
Чистые металлы начали изготавливаться только в XII веке, что связано с работами таких ученых, как Р. Бэкон, который положил начало более современным методам металлургии и чистоты металлов.
Характеристика олова
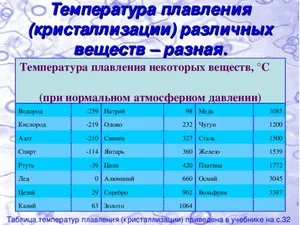
Температура плавления олова составляет 232°C, в то время как температура его кипения достигает 2600°C. Олово обладает отличной способностью смешиваться с различными металлами и, благодаря своей высокой пластичности, оно легко растекается в процессе нанесения на поверхности. В данном контексте олово служит отличным клеевым материалом, так как эффективно смачивает металлы. Производство олова, в частности, в промышленных масштабах, является более сложным процессом по сравнению с производством свинца, что обусловливает его более высокую стоимость.
В отличие от свинца, олово выглядит более привлекательно благодаря своему серебристо-белому цвету и безопасно для здоровья человека. Оно часто используется для покрытия металлических изделий, которые контактируют с пищей, таких как кухонная утварь, упаковка и фольга. Тем не менее, стоит помнить, что оловянная пыль и пара при вдыхании могут быть опасны для здоровья людей. Олово также играет важную роль в производстве различных сварочных материалов и сплавов, таких как сплавы для подшипников и трения. Кроме того, олово имеет меньшую плотность по сравнению со свинцом, что делает его более удобным в использовании; его плотность составляет 7,3 г/см³.
Олово обладает полиморфизмом, что подразумевает наличие различных модификаций в зависимости от температуры. При температуре ниже 13°C белое олово (β-модифицированное) трансформируется в серое олово (α-модифицированное). Этот фазовый переход приводит к тому, что блестящие изделия из олова могут разрушаться в серый порошок, что известно как «оловянная чума».
По некоторым данным, именно это явление стало основным фактором, приведшим к катастрофе миссии Роберта Скотта в Антарктиде. Парафин, который хранился на может находиться на промежуточных складах, вытек из контейнеров, склеенных оловом, и преобразовался в порошок из-за холода Антарктиды, что привело к потере почти всего топлива, необходимого для миссии.
Свинец и его свойства
Свинец имеет грязно-серый цвет, который образуется в результате наличия оксидной пленки, временно образующейся на его поверхности в атмосферных условиях. Это придает свинцу непримечательный и не привлекательный внешний вид. Однако, если произвести несколько проходов напильником по поверхности этого металла, можно обнаружить его блестящую голубоватую поверхность, что свидетельствует о его высоких физических свойствах. Свинец — это очень мягкий и тяжелый металл, его вес примерно в 1,5 раза больше, чем у стали. Плотность свинца составляет 11,34 г/куб. см, в то время как плотность железа составляет 7,80 г/куб. см.
Свинец был открыт в древности и использовался уже около 4000-4500 лет до нашей эры. В современной металлургии свинец добывают преимущественно из руд с помощью металлургических технологий, что позволяет получить данный элемент в чистом виде.
Температура плавления свинца составляет всего 327°C, а его температура кипения — 1 749°C. Необходимо особое внимание уделять токсичности паров свинца, поскольку этот химический элемент практически не выводится из организма. Чем выше температура расплавленного свинца, тем больше он испаряется, что подчеркивает необходимость хорошей вентиляции в помещениях, где осуществляется его плавка.
Основное назначение свинца — это производство мягких припоев вместе с оловом, что обусловлено его низкой температурой плавления.
Плотность припоев на основе серебра колеблется в пределах от 7400 до 11400 кг/м³. Низкая плотность серебросодержащих припоев характерна для таких типов припоев как PSrOSu8, PSrMO5, PSrOS 3.5-95 и PSr010-90. Наибольшую плотность имеет припой PSr3, который достигает 11,4 г/см³.
СТРУКТУРА
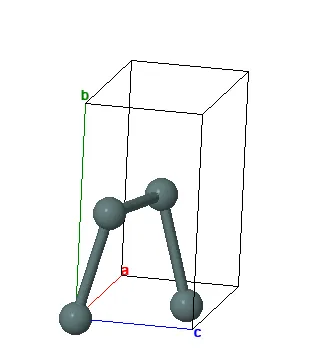
Олово имеет две аллотропные модификации: α-Sn (серое олово) со структурой гранецентрированной кубической кристаллической решетки и β-Sn (стандартное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Переход от бета-формы к альфа-форме ускоряется при понижении температуры до -30°C и в присутствии кристаллических ядер серого олова. Хотя изделия из блестящего олова могут рассыпаться в серый порошок при низких температурах («оловянная чума»), данный переход сильно замедляется наличием мелких примесей и встречается достаточно редко, поэтому представляет больше интерес для науки, чем для практического применения.

Плотность β-Sn составляет 7,29 г/см³, в то время как плотность α-Sn равняет 5,85 г/см³. Температура плавления этого материала – 231,9°C, а его температура кипения достигает 2270°C. Температурный коэффициент линейного расширения составляет 23 × 10^-6 (0-100°C); удельная теплоемкость при 0°C равна 0,225 кДж/(кг·К), что соответствует 0,0536 кал/(г·°C); теплопроводность при 0°C составляет 65,8 Вт/(м·К), то есть 0,157 кал/(см·с·°C). Удельное электрическое сопротивление при 20°C колеблется от 0,115 × 10^-6 Ом·м, что аналогично 11,5 × 10^-6 Ом·см; серое олово является антимагнитным, в то время как белое — парамагнитным.
Прочность на разрыв олова составляет 16,6 Мн/м² (1,7 кгс/мм²); при этом удлинение достигает 80-90%. Твердость по Бринеллю составляет от 38,3 до 41,2 Мн/м² (от 3,9 до 4,2 кгс/мм²). При сгибании оловянных стержней отчетливо слышно хруст, который возникает за счет трения между микрокристаллами. Заметим, что чистое олово обладает низкой механической прочностью при комнатной температуре, из-за чего оловянные стержни легко деформировать, а звук треска при этом обусловлен трением между отдельными кристаллами; именно поэтому чистое олово редко используется в промышленных целях.

Олово в природе встречается в основном в форме диффузии (или эндокристаллической). Тем не менее, олово также образует ряд минеральных форм, которые часто становятся промышленными концентрациями, предимствующим в оксоидах, таких как оловянный камень SnO2, а также сульфидных формах — желтая оловянная руда.
В общем, можно выделить несколько основных форм, в которых олово встречается в природе:
- Дисперсная форма: специфическая форма этой модификации олова в природе не установлена. Можно говорить лишь об изоморфных дисперсных формах олова, обусловленных изоморфизмом с разными элементами (например, Ta, Nb, W — чаще всего с образованием кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием сульфидных соединений). Если концентрация олова не превышает критических значений, указанные элементы могут быть заменены изоморфами, причём механизм изоморфизма варьируется.
- Минеральные формы: олово встречается также в различных минералах-конденсаторах. Обычно это минералы, содержащие железо (например, биотит, гранит, пирен, магнит, турмалин и др.), что связано с изоморфизмом, например, по реакции SN +4 + Fe +2 → 2Fe +3. В скарнах Кассиса высокие концентрации олова можно обнаружить в гранатах (до 5,8%), особенно в андрадитах, тендитах (до 2,84%) и подобных минералах.
Кроме того, олово встречается в серных месторождениях, где оно возникает в изоморфных соединениях, таких как месторождение Мясницкое (Ширинское, Приморье, Россия) и медное месторождение (Дубровское месторождение, Приморье, Россия). В месторождении Смирнов (Приморье, Россия) высокие концентрации олова были в яркой серо-серой руде. Из-за ограниченного изоморфизма допускается, что разложение твердого раствора может проходить через реакции, такие как 2Fe +2 + SnS4 или тиллит PbSnS2 и другие минералы.
ПРИМЕНЕНИЕ

Олово характеризуется безопасностью, ненадобностью применения токсичных материалов, а также устойчивостью к коррозии, что делает его идеальным для использования либо в чистом виде, либо в сплавах с другими металлами. Основные области промышленного использования олова включают производство пищевых контейнеров, электроники, бытового гидравлического оборудования, подшипников, а также оловянного железа (сплав тиндосид). Важнейшая смесь для производства жести основана на меди, которая также находится в составе оловянной жести. Так, приблизительно 33% от об общего количества производимого олова используют для изготовления жестянок. Фактически, до 60% производимого олова применяется в сплавах, содержащих медь, цинк, а также сурьму для подшипников и баббитов. В последние годы наблюдается возрождение интереса к использованию олова, поскольку оно проявляет наименьшее воздействие на окружающую среду по сравнению с более тяжелыми нежелезными металлами. Олово также используется для производства сверхпроводящих проводов на основе Nb3Sn, а также в декоративном покрытии, имитирующем золото.
Радионуклидные ядерные изомеры 117M Sn и 119M Sn выступают в качестве источников гамма-координатных спектроскопических гамма-лучей, а также изотопного и Мёссбауэровского излучения. Неметаллические соединения олова и циркония, обладая температурой плавления до 2000°C, а также высокой стойкостью к окислению при нагревании на воздухе, находят множество своих применений в высоких технологиях.
Олово является несомненно важным компонентом в производстве титановых конструкционных сплавов, а диоксид олова выступает как высокоэффективный абразив, используемый для доводки оптического стекла. Смесь оловянной соли, известная как «желтый состав», ранее использовалась для окраски шерсти.
Также олово применяется в качестве анодного материала в химических источниках энергии. Примеры таких источников включают марганцевые клетки и ртутные оксидные аккумуляторы. Использование олова в свинцово-кислотных батареях представляет собой один из самых многообещающих примеров эффективности, так как при одинаковом напряжении емкость свинцово-кислотных батарей оказывается в 2,5 раза больше, а плотность энергии на единицу объема в пять раз выше по сравнению с другими типами батарей. В последнее время также ведутся исследования по созданию изолированных двумерных слоев олова (станния) в сочетании с графеном.
Количество марок указывает на содержание олова в жестяной банке. Например, сварка PIC-40 содержит 40% олова, а PIC-60 — 60% олова.
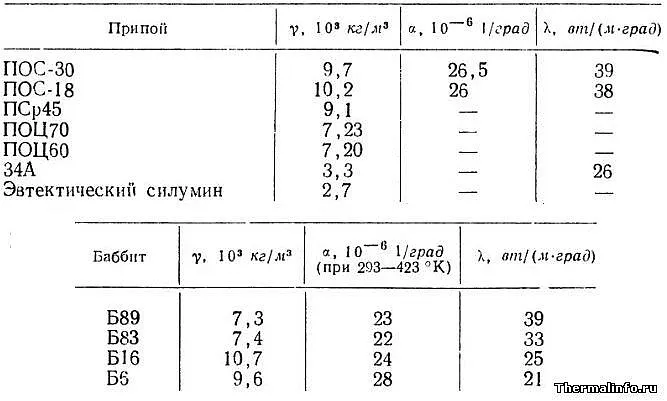
Также имеется таблица, показывающая теплофизические свойства некоторых сварочных материалов и баббитов (антифрикционных подшипниковых материалов) при комнатной температуре, с указанными свойствами: плотность, коэффициент теплового расширения и теплопроводность.
В этой таблице представлены следующие свойства сварочного материала и баббита: POS-30, POS-18, PSr45, POC70, POC60, 34A, баббит, изготовленный из силиката кремния, B83, B16, BKA, B88, B89 и B6. Следует отметить, что плотность сварного шва, коэффициент теплового расширения (CTlR) и теплопроводность сварных швов и баббита имеют сходства, однако сварные швы 34A и эвтектический кремний имеют в два-четыре раза меньшую плотность.
Состав и теплопроводность припоев и баббитов при различных температурах
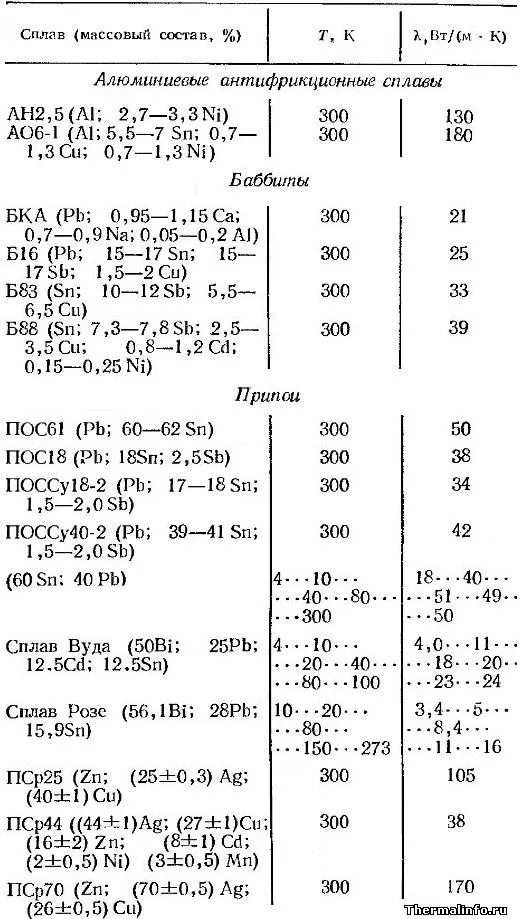
В таблице представлено содержание и значения теплопроводности различных алюминиевых сплавов, баббитов и сварочных сплавов при температурных значениях, варьирующих от 4 до 300 К (-269 до 27°C).
В рамках испытаний были протестированы следующие сварочные и подшипниковые материалы: AH2,5, AO6-1, BKA, B16, B83, B88, Posh61, Posh18, POSSu18-2, POSSu40-2, а также древесный сплав, сплав Розе, PSr25, PSr44 и PSr70.
В соответствии с результатами таблицы AO6-1 характеризуется наибольшей теплопроводностью среди противотрений, достигая значений 180 Вт/(м·К). Серебряный припой PSr70 (который основывается на серебре и меди) также демонстрирует максимальную теплопроводность среди изучаемых сварных швов и составляет 170 Вт/(м·град).
Источник.